Mẹo H2SO4 đặc chi có tính oxi hóa mạnh
Mẹo về H2SO4 đặc chi có tính oxi hóa mạnh Mới Nhất
Họ tên bố(mẹ) đang tìm kiếm từ khóa H2SO4 đặc chi có tính oxi hóa mạnh được Cập Nhật vào lúc : 2022-12-10 20:20:08 . Với phương châm chia sẻ Kinh Nghiệm về trong nội dung bài viết một cách Chi Tiết Mới Nhất. Nếu sau khi Read tài liệu vẫn ko hiểu thì hoàn toàn có thể lại phản hồi ở cuối bài để Mình lý giải và hướng dẫn lại nha.
Câu hỏi: chứng tỏ HỌ2VÌ THẾ4 Chất oxy hóa mạnh
Nội dung chính Show- I) Axit sulfuric đậm đặcII) Axit sunfuric loãngIII) Những ứng dụng của axit sunfuric trong đời sốngLƯU Ý KHI SỬ DỤNG AXIT SULFURICBIỆN PHÁP BẢO QUẢN VÀ PHÒNG NGỪAH2SO4 là gì?Tính chất vật lý của H2SO4Tính chất hóa học của H2SO4Tính chất hóa học của H2SO4 đặcTính chất hóa học của H2SO4 loãngCác dạng của axit sunfuric (H2SO4)Cách điều chế H2SO4Đốt cháy quặng pirit sắtOxi hóa SO2 thông qua oxi trong điều kiện nhiệt độ 400 – 5000C, và cần chất xúc tác V2OAxit sunfuric H2SO4 đặc hấp thụ SO3 tạo ra oleumPha loãng oleum với nướcỨng dụng của H2SO4 Điều chế axit nitric, axit clohidric trong phòng thí nghiệmH2SO4 trong công nghiệpH2SO4 trong xử lý nước thảiVideo liên quan
Câu trả lời:
– H2VÌ THẾ4 Sự pha loãng thể hiện tính oxi hóa khi giải phóng H.2.
– H2SO4 đặc thể hiện tính oxi hoá khi có spk.
– PT thể hiện tính oxi hoá của tất cả hai axit:
H2VÌ THẾ4+ Zn → ZnSO4+ HOÀN TOÀN2H2VÌ THẾ4+ Zn → ZnSO4+ HOÀN TOÀN2
2 gia đình2VÌ THẾ4 dd + Zn → ZnSO4+ VẬY2+ 2H2O
Hãy cùng trường ĐH KD & CN Tp Hà Nội Thủ Đô tìm hiểu thêm về h2so4 có tính oxi hóa mạnh nhé!
– Công thức hóa học: H2VÌ THẾ4H2VÌ THẾ4
– Axit sunfuric được sử dụng cho những mục tiêu rất khác nhau nên sẽ tồn tại ở những dạng rất khác nhau như:
+ Axit sunfuric loãng dùng trong phòng thí nghiệm thường chỉ 10%
+ Dùng cho pin khoảng chừng 33,5%
+ Hàm lượng 62,18% là axit dùng để sản xuất phân bón
+ 77,67% được sử dụng trong tháp sản xuất hoặc găng tay axit
+ 98% là axit đậm đặc
I) Axit sulfuric đậm đặc
1) Tính chất vật lý
– Là một axit mạnh
– Thích nước: HUẾ2VÌ THẾ4H2VÌ THẾ4 Hút nước mạnh, nước từ những hợp chất glucozơ cũng trở nên nó hấp thụ.
– Da tiếp xúc với axit sunfuric đặc sẽ bị bỏng nặng, cần lưu ý khi sử dụng và sản xuất axit sunfuric.
2) Tính chất hóa học
a) Tính axit mạnh:
Phản ứng với bazơ, oxit bazơ, muối tạo thành muối và nước.
b) Sự oxy hóa
Tác dụng với sắt kẽm kim loại
– H2VÌ THẾ4(d, n) ĐẦY ĐỦ2VÌ THẾ4(d, n) có tính oxi hóa rất mạnh, trừ Au và Pt hầu hết đều bị oxi hóa tạo muối (trong đó sắt kẽm kim loại có hóa trị cao nhất) + nước + sản phẩm khử.
VĐ:
Mg + 5H2VÌ THẾ4→ 4MgSO4+ HOÀN TOÀN2S + 4H2OMg + 5H2VÌ THẾ4→ 4MgSO4+ HOÀN TOÀN2S + 4H2O
Ghi chú: Nhôm, sắt, crom bị thụ động hóa trong axit sunfuric đặc nguội
Tác dụng với phi kim
2 gia đình2VÌ THẾ4+ S → 3SO2+ 2H2O2H2VÌ THẾ4+ S → 3SO2+ 2H2O
Phản ứng với những chất khử khác
2FeO + 4H2VÌ THẾ4→ Fe2(VÌ THẾ)4)3+ VẬY2+4 GIỜ2O2FeO + 4H2VÌ THẾ4→ Fe2(VÌ THẾ)4)3+ VẬY2+4 GIỜ2O
II) Axit sunfuric loãng
1) Tính chất vật lý
– Chất lỏng, sền sệt, nặng hơn nước, khó bay hơn
Độ hòa tan: hòa tan vô hạn trong nước
♦ Lưu ý: Đưa chúng từ từ2VÌ THẾ4H2VÌ THẾ4 đặc thành nước (không phải ngược lại) là một cách pha loãng axit sunfuric đặc
2) Tính chất hóa học
Là một axit mạnh, nó có tất cả những tính chất hóa học chung của axit.
– Chuyển quỳ tím thành đỏ
– Phản ứng với tất cả những sắt kẽm kim loại trước hiđro (trừ Pb) tạo thành muối sunfat và khí hiđro.
Ví dụ: Fe + H2VÌ THẾ4→ FeSO4+ H2Fe + H2VÌ THẾ4→ FeSO4+ HOÀN TOÀN2.
3. Sản xuất axit sunfuric
Axit sunfuric được sản xuất công nghiệp bằng phương pháp tiếp xúc. Phương pháp này còn có 3 quá trình chính:
Sản xuất lưu huỳnh đioxit (SO2)
– Tùy theo nguồn nguyên vật liệu sẵn có mà người ta lấy pyrit sắt sunfua hoặc FeS làm nguyên vật liệu ban đầu.2
– Đốt lưu huỳnh:
– Đốt FeS. quặng pirit sắt2
Sản xuất lưu huỳnh trioxit (SO3)
– Quá trình oxy hóa SO2 với oxy hoặc không khí dư ở 450 – 500oC, xúc tác là vanadi (V) oxit V2O5:
VÌ THẾ . sự hấp thụ3 bằng họ2VÌ THẾ4
– Sử dụng HOME2VÌ THẾ4 Hấp thụ 98% SO3được oleum H2VÌ THẾ4 .nSO3:
H2VÌ THẾ4 + nSO3 → BẠN BÈ2SO4 .nSO3
– Sau đó dùng lượng nước thích hợp để pha loãng oleum, thu được H2VÌ THẾ4 đặc biệt:
H2VÌ THẾ4.nSO3 + n2O & rarr; (n + 1) H2VÌ THẾ4
III) Những ứng dụng của axit sunfuric trong đời sống
Trong sản xuất công nghiệp
– Hàng năm, khoảng chừng 160 triệu tấn H2VÌ THẾ4được sử dụng nhiều trong sản xuất luyện kim 2%, thuốc nhuộm 2%, chất dẻo 5%, chất tẩy rửa 14%, giấy, sợi 8% …
+ Axit sunfuric được sử dụng rộng rãi trong những quá trình sản xuất sắt kẽm kim loại như sản xuất đồng, kẽm và được sử dụng trong những dung dịch tẩy rửa, tẩy rỉ mặt phẳng thép.
+ Ngoài ra, axit sunfuric còn được dùng để sản xuất nhôm sunfat (ví dụ phèn chua để làm giấy). Sản xuất muối sunfat, tẩy rửa sắt kẽm kim loại trước khi xi mạ, sản xuất thuốc nổ, chất dẻo, thuốc nhuộm, sản xuất dược phẩm.
Hỗn hợp axit và nước được sử dụng làm chất điện phân trong nhiều loại pin, axit chì, v.v.
Trong phòng thí nghiệm
– Điều chế axit yếu hơn: HNO3. HCl.
Trong xử lý nước thải
– Sản xuất nhôm hydroxit được sử dụng trong những nhà máy sản xuất xử lý nước để lọc những tạp chất, cũng như cải tổ mùi vị của nước, trung hòa độ pH trong nước, và được sử dụng để vô hiệu những ion Mg2+Sự thay đổi2+ có trong nước thải.
Trong sản xuất phân bón
– Axit sunfuric (60% sản lượng thế giới) được sử dụng đa phần trong sản xuất axit photphoric, được sử dụng để sản xuất phân lân, canxi đihiđro photphat, amoni photphat, và cũng để sản xuất amoni sunfat.
Các hiệu suất cao khác của axit sunfuric:
– Sản xuất nhôm sunfat, được gọi là phèn giấy. Nó hoàn toàn có thể phản ứng với một lượng nhỏ xà phòng trên sợi bột giấy để tạo ra gelatin nhôm cacboxylat, giúp đóng rắn sợi bột giấy vào mặt phẳng cứng của giấy.
LƯU Ý KHI SỬ DỤNG AXIT SULFURIC
Bạn cần lưu ý những rủi ro tiềm ẩn tiềm ẩn tiềm ẩn của dung dịch Axit này để hoàn toàn có thể sử dụng một cách bảo vệ an toàn và đáng tin cậy.
+ Axit sunfuric H2VÌ THẾ4 rất nguy hiểm, chất bắn vào da hoàn toàn có thể gây bỏng nặng, bắn vào mắt hoàn toàn có thể dẫn đến mù lòa, những vật liệu bằng giấy, vải sẽ bị cháy nếu tiếp xúc với H2VÌ THẾ4
Khi đun nóng axit sunfuric thì SO. khí sẽ xuất hiện2 và vì thế3. Đây là những khí rất độc.
Khi nào cần pha loãng axit sunfuric H2VÌ THẾ4 tuyệt đối không thêm nước vào axit trước mà luôn cho H từ từ vào.2VÌ THẾ4 Vào trong nước.
+ BẠN BÈ2VÌ THẾ4 Nó hút ẩm cực kỳ mạnh và do đó là một chất hút ẩm tốt, áp suất hơi nước trên H2SO4 là 0,003mmHg.
+ Ở nhiệt độ 30 – 40 độ C khởi đầu bốc khói và khi đun nóng thêm sẽ tạo ra SO. hơi nước3. Bắt đầu sôi ở nhiệt độ 290 độ C và nhiệt độ sẽ tăng nhanh gọn cho tới lúc SO. dừng phát hành3. Phần hyđrat còn sót lại chứa 98,3% H2VÌ THẾ4 và Đun sôi ở 338 độ C.
Khi nguội, nó chuyển thành dạng rắn, tinh thể của axit sunfuric H2VÌ THẾ4 Nóng chảy ở 10,49 độ C. Tuy nhiên, axit lỏng hoàn toàn có thể thuận tiện và đơn giản đóng băng và không đông đặc dưới 0 độ C.
BIỆN PHÁP BẢO QUẢN VÀ PHÒNG NGỪA
Để dữ gìn và bảo vệ
+ Bảo quản axit sunfuric trong bồn nhựa, thùng phuy nhựa. Không tàng trữ trong bồn làm bằng nhôm, sắt kẽm kim loại, thép không gỉ và kẽm vì đây là sắt kẽm kim loại ăn mòn rất mạnh. Các bể sắt đã lớn chưa?2VÌ THẾ4 phải phủ lớp PU. Đậy chặt nắp, dữ gìn và bảo vệ nơi khô ráo, tránh có bazơ hoặc chất khử.
+ Tránh đặt gần những sắt kẽm kim loại, sắt kẽm kim loại nhẹ, những chất có tính axit để tránh gây cháy và nổ như HCl, axit nitric, axit photphoric… gây nguy hiểm.
Các giải pháp phòng ngừa
+ Đây là hóa chất nguy hiểm, tiếp xúc với da sẽ gây bỏng nặng, vào mắt gây tổn thương mắt vĩnh viễn nên phải tránh tiếp xúc trực tiếp, không được uống hoặc hít phải.
+ Khi sử dụng hoặc bơm vào bồn phải mặc quần áo bảo lãnh lao động, đeo khẩu trang chuyên được dùng để bảo vệ mắt, sử dụng két sắt đã được cấp phép khi vận chuyển trên đường.
+ Không để axit chảy vào khối mạng lưới hệ thống thoát nước.
+ Nếu có rò rỉ cần cách ly nơi nguy hiểm, những người dân không liên quan hoặc không đeo bảo lãnh không được vào nơi nguy hiểm.
+ Khi thiết yếu hoàn toàn có thể dùng thanh chắn bằng nhựa hoặc rãnh bảo vệ an toàn và đáng tin cậy để ngăn axit tràn ra ngoài.
Đăng bởi: Trường ĐH KD & CN Tp Hà Nội Thủ Đô
Chuyên mục: Lớp 10, Hóa 10
Bạn thấy nội dung bài viết Chứng minh H2SO4 có tính oxi hóa mạnh có xử lý và xử lý đươc vấn đề bạn tìm hiểu không?, nếu không hãy comment góp ý thêm về Chứng minh H2SO4 có tính oxi hóa mạnh phía dưới để https://hubm.edu/ hoàn toàn có thể sửa đổi & cải tổ nội dung tốt hơn cho độc giả nhé! Cám ơn bạn đã ghé thăm Website ĐH KD & CN Tp Hà Nội Thủ Đô
#Chứng #minh #H2SO4 #có #tính #oxi #hóa #mạnh
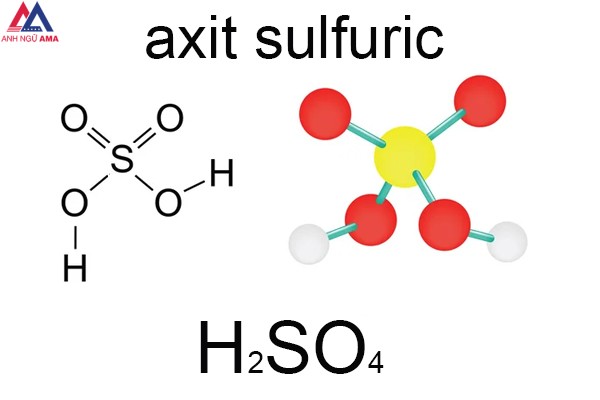
Axit Sunfuric là hợp chất hóa học vô cùng phổ biến và được ứng dụng rộng rãi trong đời sống xã hội. H2SO4 là gì? Tính chất vật lý và hóa học của loại Axit này là gì? Hãy cùng tìm hiểu về H2SO4 ngay sau đây nhé.
H2SO4 là gì?
H2SO4 (Axit Sunfuric) được mệnh danh là ông vua trong hóa học. Giữ vai trò vô cùng quan trọng trong việc phát triển những ngành công nghiệp lúc bấy giờ.
H2SO4 là axit vô cơ phổ biến nhất lúc bấy giờ. Nó được tạo thành từ nguyên tố lưu huỳnh (S), oxy (O) và hydro (H). Công thức hóa học của loại Axit này là H2SO4. Tên trong Tiếng Anh của H2SO4 là Acid Sulfuric. Loại Axit này còn được nghe biết dưới tên gọi dầu Sulfate và Hydro sulfate.
 H2SO4 là gì
H2SO4 là gì
Xem lại bảng tuần hoàn những nguyên tố hóa học
Tính chất vật lý của H2SO4
Tính chất vật lý của H2SO4 đặc hay loãng cũng đều như nhau, là dạng chất lỏng hơi nhớt không màu không mùi không vị. H2SO4 khó bay hơi, nó nặng hơn nước và tan vô hạn trong nước.
Axit Sunfuric đặc háo nước và khi hút nước sẽ tỏa nhiều nhiệt. Khi thực hành thí nghiệm, nên làm cho từ từ H2SO4 đặc vào nước. Tuyệt đối không làm ngược lại vì Axit sẽ bắn lên gây bỏng.
H2SO4 hoàn toàn có thể than hóa những hợp chất hữu cơ.
Tính chất hóa học của H2SO4
H2SO4 có tính axit rất mạnh, tính bào mòn của loại Axit này cũng rất đáng kể. Axit Sunfuric hoàn toàn có thể gây nguy hiểm cho bất kỳ thứ gì chạm vào nó nếu đủ nồng độ nhất định.
Axit Sunfuric có độ dịch chuyển tương đối thấp nên giữ vai trò quan trọng trong việc điều chế nhiều chủng loại Acid dễ bay hơi. Do đặc tính háo nước của tớ, H2SO4 còn được sử dụng để làm khô nhiều loại khí không phản ứng với axit.
Tính Axit của H2SO4 hoàn toàn có thể làm quỳ tím hóa đỏ.
Axit Sunfuric tồn tại dưới hai loại: axit đặc và axit loãng.
 tính chất hóa học của H2SO4
tính chất hóa học của H2SO4
Tính chất hóa học của H2SO4 đặc
Trong H2SO4, nguyên tố lưu huỳnh có mức oxi hóa +6 là cao nhất của nguyên tố này. Dẫn đến, H2SO4 đặc có tính axit mạnh, tính oxi hóa và háo nước mạnh.
Do tính Axit mạnh mẽ và tự tin của tớ nên H2SO4 tác dụng được với hầu như tất cả sắt kẽm kim loại ( trừ Au và Pt). Axit Sunfuric đặc, nóng tác dụng với Kim loại tạo thành muối sắt kẽm kim loại có hóa trị cao, nước và SO2 ( H2S, S ).
2Al +H2SO4 đặc nóng → Al2(SO4)3 + 3SO2 + 6H2O
Cu + H2SO4đặc nóng → CuSO4 + SO2 + 2H2O
2Fe +H2SO4đặc nóng → Fe2(SO4)3 + 3SO2 + 6H2O
3Cr + 4H2SO4đặc nóng → 3CrSO4 + 4H2O + S
H2SO4 đặc nguội sẽ bị thụ động hoá với nhôm ( Al), sắt ( Fe) và Crom (Cr) nên không thể sinh ra phản ứng.
Axit Sunfuric đặc tác dụng với phi kim tạo thành oxit phi kim, nước và khí SO2
S +2H2SO4đặc nóng → 3SO2 + 2H2O
Axit Sunfuric đặc nóng tác dụng với những chất khử khác tạo thành muối, nước và khí SO2
H2SO4đặc nóng + 8HI → H2S + 4I2 + 4H2O
H2SO4 đặc có tính háo nước
Thí nghiệm: Cho H2SO4 đặc vào lọ đựng đường. Quan sát hiện tượng kỳ lạ ta thấy đường chuyển sang màu đen và sôi trào.
Phương trình mô tả phản ứng này như sau:
C12H22O11 + H2SO4 → 12C + H2SO4 .11H2O
Tính chất hóa học của H2SO4 loãng
Axit Sunfuric ở dạng loãng là một Axit mạnh, có đầy đủ tính chất của một Axit thường gặp như:
– H2SO4 làm quỳ tím hóa đỏ.
– Tác dụng với Kim loại, Bazo, Oxit Bazo và muối để tạo ra những chất thiết yếu.
– Axit Sunfuric tác dụng với sắt kẽm kim loại đứng trước H trừ PB tạo thành muối Sunfat:
Fe + H2SO4 → FeSO4 + H2 bay hơi.
– Axit Sunfuric tác dụng với Oxit Bazo tạo thành muối mới và nước:
FeO + H2SO4 → FeSO4 + H2O
– Axit Sunfuric kết phù phù hợp với Bazo tạo thành muối mới + nước:
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
– Axit Sunfuric tác dụng với Muối tạo thành Axit mới và Muối mới:
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2↑
HCO3 là một Axit yếu, nên khi được sinh ra đã nhanh gọn trở thành H2O và CO2.
Các dạng của axit sunfuric (H2SO4)
Tùy theo mục tiêu sử dụng mà H2SO4 tồn tại ở nhiều dạng rất khác nhau:
- H2SO4 loãng được sử dụng trong phòng thí nghiệm chỉ là 10%.
Axit Sunfuric được sử dụng cho bình ắc quy có nồng độ ở khoảng chừng 33,5%.
Hàm lượng 62,18% thường được dùng để sản xuất phân bón.
Trong tháp sản xuất hay axit glover, hàm lượng H2SO4 được sử dụng là 77,67%.
Axit Sunfuric đậm đặc có nồng độ là 98%.
Tham khảo bảng đơn vị đo khối lượng
Cách điều chế H2SO4
Đốt cháy quặng Pirit sắt là một trong những cách điều chế H2SO4 phổ biến; Oxi hóa SO2 thông qua oxi ở nhiệt độ từ 400 – 500 độ C; Hoặc pha loãng chất oleum với lượng nước vừa đủ để tạo ra H2SO4.
 cách điều chế h2so4
cách điều chế h2so4
Đốt cháy quặng pirit sắt
FeS2 + O2 → SO2 + Fe2O3
Oxi hóa SO2 thông qua oxi trong điều kiện nhiệt độ 400 – 5000C, và cần chất xúc tác V2O
SO2 + O2 → SO3
Axit sunfuric H2SO4 đặc hấp thụ SO3 tạo ra oleum
nSO3 + H2SO4 → H2SO4.nSO3
Pha loãng oleum với nước
H2SO4 .nSO3 + (n+1) H2O→ (n+1)H2SO4
Tham khảo thêm nhiều tài liệu Hóa học khác tại AMA
Ứng dụng của H2SO4
Axit sunfuric là được dùng phổ biến trong nhiều ngành công nghiệp với vai trò là nguyên vật liệu chính hoặc chất xúc tác những phản ứng hóa học. H2SO4 được sử dụng rất nhiều trong quá trình sản xuất phân bón, chất tẩy rửa tổng hợp, tơ sợi hóa học, chất dẻo và sơn màu.
Điều chế axit nitric, axit clohidric trong phòng thí nghiệm
Axit Sunfuric được dùng để điều chế những axit yếu hơn như HCl, HNO3. Đáp ứng những nhu yếu về hóa chất trong phòng thí nghiệm.
H2SO4 trong công nghiệp
Ước tính thường niên có tầm khoảng chừng 160 triệu tấn Axit Sunfuric được sử dụng. H2SO4 được dùng nhiều và nổi bật trong những ngành sản xuất luyện kim, phẩm nhuộm, chất dẻo, chất dùng để tẩy rửa, giấy và sợi…
H2SO4 là axit mạnh nên được sử dụng phổ biến trong quá trình sản xuất đồng, kẽm,…Làm sạch mặt phẳng thép hoặc những dung dịch tẩy gỉ.
Sản xuất nhôm sunfat từ H2SO4 là phương pháp tối ưu. Axit Sunfuric còn được dùng để sản xuất nhiều chủng loại muối sunfat, tẩy rửa sắt kẽm kim loại trước khi tiến hành mạ, sản xuất thuốc nổ,…
Hỗn hợp H2SO4 với nước được dùng rộng rãi trong ac-quy với vai trò là chất điện giải.
H2SO4 trong xử lý nước thải
Axit Sunfuric được dùng để sản xuất nhôm hidroxit. Sau đó, nhôm hidroxit là được sử dụng để lọc những tạp chất, cũng như cải tổ mùi vị của nước, giúp trung hòa pH trong nước, và sử dụng để vô hiệu những ion sắt kẽm kim loại như Mg2+, Ca2+ có trong nước thải. Ngoài ra, H2SO4 còn nhiều ứng dụng rộng rãi, bao quát nhiều khía cạnh trong đời sống.
Qua nội dung bài viết, tất cả chúng ta đã cùng tìm hiểu H2SO4 là gì, tính chất, cách sản xuất, hiệu suất cao của hợp chất này. AMA mong gửi đến bạn đọc những kiến thức và kỹ năng hữu ích nhất về hợp chất hóa học này nhé.
Tải thêm tài liệu liên quan đến nội dung bài viết H2SO4 đặc chi có tính oxi hóa mạnh
Post a Comment