Review Đánh giá phương pháp quy đổi hóa học
Thủ Thuật về Đánh giá phương pháp quy đổi hóa học Mới Nhất
Bùi Phương Thảo đang tìm kiếm từ khóa Đánh giá phương pháp quy đổi hóa học được Cập Nhật vào lúc : 2022-12-07 03:14:03 . Với phương châm chia sẻ Kinh Nghiệm Hướng dẫn trong nội dung bài viết một cách Chi Tiết 2022. Nếu sau khi Read nội dung bài viết vẫn ko hiểu thì hoàn toàn có thể lại phản hồi ở cuối bài để Ad lý giải và hướng dẫn lại nha. Tải app VietJack. Xem lời giải nhanh hơn!
Tải app VietJack. Xem lời giải nhanh hơn!- Phương pháp quy đổi trong hóa học cực hay, rõ ràng, có lời giảiPhương pháp giảiVí dụ minh họaBài tập tự luyệnNgân hàng trắc nghiệm miễn phí ôn thi THPT Quốc Gia tại khoahoc.vietjack.comCHỈ CÒN 250K 1 KHÓA HỌC BẤT KÌ, VIETJACK HỖ TRỢ DỊCH COVID
Phương pháp quy đổi trong hóa học cực hay, rõ ràng, có lời giải
Phương pháp giải
1. Nội dung
Quy đổi là phương pháp biến hóa toán học đưa bài toán ban đầu với một hỗn hợp những chất phức tạp trở thành một bài toán đơn giản hơn, qua đó làm những phép tính trở nên ngắn gọn, thuận tiện và đơn giản.
2. Phạm vi sử dụng
Khi gặp những bài toán hỗn hợp nhiều chất nhưng bản chất chỉ gồm 2 ( hoặc 3) nguyên tố:
+ Bài toán về hỗn hợp hợp chất của Fe, Cu,…
+ Bài toán về hỗn hợp đồng đẳng, thủy phân hóa, hiđro hóa, ankan hóa,…
Chú ý:
Số electron nhường, nhận không đổi
- Trong quá trình tính toán theo phương pháp quy đổi đôi khi ta gặp số âm đó là vì sự bù trừ khối lượng của những chất trong hỗn hợp. Trong trường hợp này ta vẫn tính toán thông thường và kết quả ở đầu cuối vẫn thỏa mãn.
- Khi giả định hỗn hợp những chất thành một chất thì chất đó hoàn toàn có thể không còn thực, thông số của những nguyên tử trong công thức hoàn toàn có thể không phải là số tự nhiên mà hoàn toàn có thể là số thập phân dương.
- Phương pháp quy đổi tuy nhiên được xem là phương pháp rất hay dùng để xử lý và xử lý một số trong những bài toán liên quan đến Fe và hợp chất của Fe ... Tuy nhiên nếu chỉ áp dụng phương pháp quy đổi thì ta không thể giải toán nên khi áp dụng phương pháp quy đổi ta nên phải kết phù phù hợp với những phương pháp khác ví như:
+ Định luật bảo toàn khối lượng
+ Định luật bảo toàn nguyên tố
+ Định luật bảo toàn electron
+ Định luật bảo toàn điện tích
Ví dụ minh họa
Ví dụ 1: Hòa tan hoàn toàn hỗn hợp gồm 0,002 mol FeS2 và 0,003 mol FeS vào lượng dư dung dịch H2SO4 đặc nóng thu được Fe2(SO4)3, SO2 và H2O. Hấp thụ hết lượng SO2 trên bằng 1 lượng vừa đủ dung dịch KMnO4 thu được dung dịch X có pH = 2. Thể tích của dung dịch X là
A. 2,00 lit.
B. 1,150 lit.
C. 1,114 lit.
D. 2,281it
Giải
Cách 1: Quy đổi số oxi hóa
Sau toàn bộ quá trình, số oxi hóa ở đầu cuối của lưu huỳnh là +4 (trong SO2).
Giả sử S trong FeS2 và FeS đều là S+4.
Khi đó, có những quá trình nhường và nhận electron như sau:
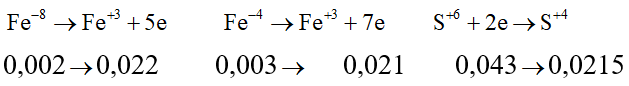
Cách 2: Quy đổi hỗn hợp những chất
Quy đổi hỗn hợp ban đầu thành Fe và S.
⇒Đáp án D
Ví dụ 2: Hoà tan hoàn toàn 49,6 gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4 bằng H2SO4 đặc, nóng dư thu được dung dịch Y và 8,96 lít khí SO2 (đktc). Thành phần phần trăm về khối lượng của oxi trong hỗn hợp X và khối lượng muối trong dung dịch Y lần lượt là:
A. 20,97% và 140 gam.
B. 37,50% và 140 gam.
C. 20,97% và 180 gam
D. 37,50% và 120 gam.
Giải
Quy đổi hỗn hợp X thành Fe (a mol) và O (b mol)
Các quá trình nhường và nhận electron:
Theo định luật bảo toàn khối lượng ta có: 56a + 16b = 49,6 (1)
Theo định luật bảo toàn electron ta có: 0,4.2 + 2b = 3a(2)
(1) và (2) => a = 0,7; b = 0,65 (mol)
⇒Đáp án A
Ví dụ 3: Cho l00ml dung dịch A chứa NaOH 0,1M và NaAlO2 0,3M. Thêm từ từ dung dịch HCl 0,1M vào dung dịch A cho tới lúc kết tủa tan trở lại 1 phần. Đem nung kết tủa đến khối lượng không đổi thì thu được l,02g chất rắn. Thể tích dung dịch HCl 0,1M đã dùng là:
A. 0,6 lít
B. 0,5 lít
C. 0,55 lít
D. 0,70 lít
Giải
Ta quy đổi hỗn hợp ban đầu thành hỗn hợp NaOH (0,04 mol) và Al(OH)3 (0,03 mol)
⇒V = 0,7 lít ⇒Đáp án D
Ví dụ 4: Hỗn hợp X gồm 2 ankin là đồng đẳng sau đó có số nguyên tử C nhỏ hơn 5 và ancol etylic. Đốt cháy hoàn toàn 0,3 mol X cần dùng 28 lít O2 (đktc). Mặt khác, cho 28g X và bình đựng Na dư, thấy thoát ra 11,2 lít khí (đktc). Phần trăm khối lượng của ancol etylic trong hỗn hợp X là:
A. 32,86%
B. 65,71%
C. 16,43%
D. 22,86%
Giải:
Quy đổi 28g hỗn hợp X thành: C2H5OH (a mol); C2H2 (b mol); CH2 ( c mol)
( CH2 không phải là một trong chất chỉ là nhóm nên nó chỉ có thành phần khối lượng mà không được tính vào số mol hỗn hợp)
⇒46a + 26b + 14c = 28 (1)
Khi cho X qua bình đựng Na dư, ancol bị giữ lại phản ứng và sinh ra 0,5mol H2 và hỗn hợp ankin không phản ứng thoát ra
⇒0,5a + b = 11,2 : 22,4 = 0,5 mol (2)
Ta có trong 0,3 mol hỗn hợp X có: ka mol C2H5OH; kb mol C2H2 và kc mol CH2 (k là tỉ lệ khối lượng của 0,3 mol X với 28g X)
⇒k(a+b) = 0,3 mol
Viết phương trình đốt cháy ta có n O2 = k(3a + 2,5b + 1,5c) = 0,125 mol
Từ (1)(2)(3) ⇒a = 0,2 mol; b = 0,4 mol; c = 0,6 mol
%m ancol = (0,2.46/28).100% = 32,86%
⇒Đáp án A
Ví dụ 5: X, Y, Z là ba axit cacboxylic đơn chức cùng dãy đồng đẳng (MX < MY < MZ). T là este tạo bởi X, Y, Z với một ancol no, ba chức, mạch hở E. Đốt cháy hoàn toàn 26,6g hỗn hợp M gồm X, Y, Z T ( trong đó Y và Z có cùng số mol) bằng lượng vừa đủ khí O2, thu được 22,4 lít CO2 ( đktc) và 16,2g H2O. Mặt khác, đun nóng 26,6g M với lượng dư dung dịch AgNO3/NH3, sau khi những phản ứng xảy ra hoàn toàn thu được 21,6g Ag. Mặt khác, cho 13,3g M phản ứng hết với 400ml dung dịch NaOH và đun nóng, thu được dung dịch N. Cô cạn dung dịch N thu được m gam chất rắn khan. Gía trị m sớm nhất với:
A. 24,74
B. 38,04
C. 16,74
D. 25,10g
Giải:
Vì M phản ứng với AgNO3/NH3 sinh ra Ag nên X là HCOOH. Mà X, Y, Z cùng dãy đồng đẳng nên chúng là 3 axit no, đơn chức, mạch hở.
Ta có: Este = axit + ancol – H2O
Do đó ta quy đổi hỗn hợp M thành:
Ghép CH2: Vì MX < MY < MZ nên Y ít nhất là CH3COOH, Z ít nhất là C2H5COOH
⇒X: HCOOH: 0,1 mol;
Y: CH3COOH: 0,15 mol
Z: C2H5COOH: 0,15 mol
C3H2: O,05
Bảo toàn nguyên tố C thấy: CH2 = 0 mol ⇒CH2 đã được ghép hết đi vào hết axit
⇒m axit = 0,4.46 + 0,45.14 = 24,7g
⇒m rắn = ½ (24,6 + 0,8.40 – 0,4.18) = 24,75g
⇒Đáp án A
Bài tập tự luyện
Bài 1: Hỗn hợp X gồm FeO, Fe2O3 và Fe3O4 có khối lượng là 38,4 gam. Hòa tan X trong dung dịch HCl dư thu được dung dịch Y chứa 25,4 gam muối FeCl2. Khối lượng muối FeCl3 trong dung dịch Y là:
A. 24,375 g.
B. 48,75 g.
C. 32,5 g.
D. 16,25 g.
Hiển thị đáp ánHướng dẫn giải:
Các phản ứng xảy ra khi cho hỗn hợp X vào dung dịch HCl:
Sản phẩm muối tạo thành chỉ gồm FeCl2 và FeCl3
Quy đổi hỗn hợp X ban đầu thành hỗn hợp gồm FeO và Fe2O3.
Ta có:
⇒Đáp án B
Bài 2: Hòa tan hoàn toàn 3,76 gam hỗn hợp X ở dạng bột gồm S, FeS, FeS2 trong dung dịch HNO3 thu được 0,48 mol NO2 và dung dịch D. Cho dung dịch D tác dụng với Ba(OH)2 dư, lọc kết tủa và nung đến khối lượng không đổi thu được m gam hỗn hợp rắn. Giá trị của m là:
A. 11,65 gam.
B. 12,815 gam.
C. 13,98 gam.
D. 17,545 gam.
Hiển thị đáp ánHướng dẫn giải:
Quy hỗn hợp thành hỗn hợp gồm Fe (a mol)và S (b mol)
=> 56a + 32b = 3,76
Bảo toàn eletron
⇒Đáp án D
Bài 3: Hoà tan hoàn toàn m gam hỗn hợp X gồm Fe, FeCl2, FeCl3 trong H2SO4 đặc nóng, thoát ra 4,48 lít khi SO2 duy nhất (đktc) và dung dịch Y. Thêm NH3 dư vào Y thu được 32,1 gam kết tủa. Giá trị m là
A. 16,8.
B. 17,75.
C. 25,675.
D. 34,55.
Hiển thị đáp ánHướng dẫn giải:
Ta quy đổi hỗn hợp thành hỗn hợp chứa Fe (a mol) và Cl (b mol):
⇒Đáp án D
Bài 4: Cho 169 gam oleum vào 200 gam dung dịch H2SO4 49,6% ta được dung dịch mới có nồng độ 80%. Công thức của oleum là:
A. H2SO4.2SO3.
B. H2SO4.4SO3.
C. H2SO4.5SO3.
D. H2SO4.3SO3.
Hiển thị đáp ánHướng dẫn giải:
Quy đổi olem thành H2SO4 có nồng độ x% (x >100)
⇒Đáp án D
Bài 5: Cho 61,2g hỗn hợp X gồm Cu và Fe3O4 tác dụng với dung dịch HNO3 loãng, đun nóng, khuấy đều. Sau khi những phản ứng xảy ra hoàn toàn thu được 3,36 lít NO (sản phẩm khử duy nhất, ở đktc), dung dịch Y và 2,4g sắt kẽm kim loại. Cô cạn Y thu được m gam muối khan. Giá trị của m là:
A. 137,1.
B. 151,5.
C. 97,5.
D. 108,9.
Hiển thị đáp ánHướng dẫn giải:
Quy đổi X thành những đơn chất: Cu (x mol); Fe (l,5y mol); O2 (y mol) => 64x + 116y = 61,2 - 2,4 = 58,8
Bảo toàn electron ta có: ne cho = ne nhận
⇒Đáp án B
Bài 6: Cho 39,2 gam hỗn họp M gồm Fe, FeO, Fe3O4, Fe2O3, CuO và Cu tác dụng vừa đủ với HNO3 nồng độ a (mol/lít), thu được 0,2 mol NO (sản phẩm khử duy nhất). Giá trị của a là:
A. 2,0.
B. 1,5.
C. 3,0.
D. 1,0.
Hiển thị đáp ánHướng dẫn giải:
Coi hỗn hợp gồm Fe (x mol); Cu (y mol) và 0,45 mol O
=> 56x + 64y + 7,2 = 39,2
⇒Đáp án A
Bài 7: Hỗn hợp X gồm Mg, MgS và S. Hòa tan hoàn toàn m gam X trong HNO3 đặc, nóng thu được 2,912 lít khí N2 duy nhất (đktc) và dung dịch Y. Thêm Ba(OH)2 dư vào Y được 46,55 gam kết tủa. Giá trị của m là:
A. 4,8 gam.
B. 7,2 gam.
C. 9,6 gam.
D. 12,0 gam.
Hiển thị đáp ánHướng dẫn giải:
Quy hỗn hợp thành hỗn hợp gồm Mg (a mol) và S (b mol)
⇒Đáp án C
Bài 8: Hỗn hợp X có tỉ khối so với H2 là 27,8 gồm butan, metylxiclopropan, but-2-en, etylaxetilen và đivinyl. Khi đốt cháy hoàn toàn 0,15 mol X, tổng khối lượng của CO2 và H2O thu được là:
A. 34,50 g.
B. 36,66 g.
C. 37,20 g.
D. 39,90 g.
Hiển thị đáp ánHướng dẫn giải:
Các chất tham gia cấu trúc X trong phân tử đều có 4C.
Ta quy hỗn hợp đầu thành hỗn hợp C (0,6 mol) và H (a mol)
⇒Đáp án B
Bài 9: Cho 13,35 gam hỗn hợp X gồm CH2NH2CH2COOH và CH3CHNH2COOH tác dụng với V ml dung dịch NaOH 1M thu được dung dịch Y. Biết dung dịch Y tác dụng vừa đủ với 250 ml dung dịch HCl 1M. Giá trị của V là:
A. 100 ml
B. 150 ml
C. 200 ml.
D. 250 ml.
Hiển thị đáp ánHướng dẫn giải:
⇒Đáp án A
Bài 10: Cho 20,15 gam hỗn hợp X gồm CH2NH2COOH và CH3CHNH2COOH tác dụng với 200 ml dung dịch HCl 1M thu được dung dịch Y. Y tác dụng vừa đủ với 450 ml dung dịch NaOH 1M. Phần trăm khối lượng của mỗi chất trong X là:
A. 55,83% và 44,17%.
B. 58,53% và 41,47%.
C. 53,58% và 46,42%.
D. 52,59% và 47,41%
Hiển thị đáp ánHướng dẫn giải:
Quy hỗn hợp Y thành X (x mol) và HC1 (0,2 mol)
Gọi a, b lần lượt là số mol CH2NH2COOH và CH3CHNH2COOH
Đáp án A
Xem thêm những phương pháp giải nhanh bài tập Hóa học hay khác:
- Phương pháp bảo toàn điện tích trong hóa học hay, rõ ràng, có lời giảiPhương pháp bảo toàn electron trong hóa học hay, rõ ràng, có lời giảiPhương pháp bảo toàn khối lượng trong hóa học cực hay, có lời giảiPhương pháp bảo toàn nguyên tố trong hóa học cực hay, có lời giảiPhương pháp chọn đại lượng thích hợp trong hóa học cực hay, có lời giảiPhương pháp đồ thị trong hóa học hay, rõ ràng, có lời giảiPhương pháp đường chéo trong hóa học cực hay, rõ ràng, có lời giảiPhương pháp trung bình trong hóa học cực hay, rõ ràng, có lời giảiPhương pháp sử dụng phương trình ion thu gọn trong hóa học cực hay, có lời giảiPhương pháp tăng giảm khối lượng trong hóa học cực hay, có lời giải
[embed]https://www.youtube.com/watch?v=ieCkGJwl-s8[/embed]
Giới thiệu kênh Youtube VietJack
Ngân hàng trắc nghiệm miễn phí ôn thi THPT Quốc Gia tại khoahoc.vietjack.com
- Hơn 75.000 câu trắc nghiệm Toán có đáp án Hơn 50.000 câu trắc nghiệm Hóa có đáp án chi tiếtGần 40.000 câu trắc nghiệm Vật lý có đáp ánHơn 50.000 câu trắc nghiệm Tiếng Anh
có đáp ánKho trắc nghiệm những môn khác
CHỈ CÒN 250K 1 KHÓA HỌC BẤT KÌ, VIETJACK HỖ TRỢ DỊCH COVID
Tổng hợp những video dạy học từ những giáo viên tinh luyện - CHỈ TỪ 399K tại khoahoc.vietjack.com
Tổng đài tương hỗ đăng ký khóa học: 084 283 45 85
cac-phuong-phap-giai-nhanh-hoa-hoc-huu-co-vo-co.jsp
Các loạt bài lớp 12 khác
- Soạn Văn 12Soạn Văn 12 (bản ngắn nhất)Văn mẫu lớp 12Giải bài tập Toán 12Giải BT Toán 12 nâng cao (250 bài)Bài tập trắc nghiệm Giải tích 12 (100 đề)Bài tập trắc nghiệm Hình học 12 (100
đề)Giải bài tập Vật lý 12Giải BT Vật Lí 12 nâng cao (360 bài)Chuyên đề: Lý thuyết - Bài tập Vật Lý 12 (có đáp án)Bài tập trắc nghiệm
Vật Lí 12 (70 đề)Luyện thi đại học trắc nghiệm môn Lí (18 đề)Giải bài tập Hóa học 12Giải bài tập Hóa học 12 nâng caoBài
tập trắc nghiệm Hóa 12 (80 đề)Luyện thi đại học trắc nghiệm môn Hóa (18 đề)Giải bài tập Sinh học 12Giải bài tập Sinh 12 (ngắn nhất)Chuyên đề Sinh học 12Đề kiểm tra Sinh 12 (có đáp án)(hay nhất)Ôn thi đại học môn Sinh (theo chuyên đề)Luyện thi đại học trắc nghiệm môn
Sinh (18 đề)Giải bài tập Địa Lí 12Giải bài tập Địa Lí 12 (ngắn nhất)Giải Tập map và bài tập thực hành Địa Lí 12Bài tập trắc nghiệm Địa Lí 12 (70 đề)Luyện thi đại học trắc nghiệm môn Địa (20 đề)Giải bài tập Tiếng anh 12Giải bài tập Tiếng anh 12 thí điểm
Giải bài tập Lịch sử 12Giải tập map Lịch sử 12Bài tập trắc nghiệm Lịch Sử 12Luyện thi đại học trắc nghiệm
môn Sử (20 đề)Giải bài tập Tin học 12Giải bài tập GDCD 12Giải bài tập GDCD 12 (ngắn nhất)Bài tập trắc nghiệm GDCD
12 (37 đề)Luyện thi đại học trắc nghiệm môn GDCD (20 đề)Giải bài tập Công nghệ 12

Post a Comment