Review Sản phẩm tạo thành tử phản ứng cộng H2 của Toluen khí có xúc tác Ni là
Mẹo Hướng dẫn Sản phẩm tạo thành tử phản ứng cộng H2 của Toluen khí có xúc tác Ni là Chi Tiết
Họ và tên đang tìm kiếm từ khóa Sản phẩm tạo thành tử phản ứng cộng H2 của Toluen khí có xúc tác Ni là được Update vào lúc : 2022-12-02 11:02:05 . Với phương châm chia sẻ Mẹo về trong nội dung bài viết một cách Chi Tiết Mới Nhất. Nếu sau khi tham khảo nội dung bài viết vẫn ko hiểu thì hoàn toàn có thể lại phản hồi ở cuối bài để Admin lý giải và hướng dẫn lại nha.CÔNG TY CỔ PHẦN TIN HỌC LẠC VIỆT
23 Nguyễn Thị Huỳnh, Phường 8, Quận Phú Nhuận, TP. Hồ Chí Minh
Nội dung chính Show- A. BENZEN VÀ ĐỒNG ĐẲNGB. MỘT SỐ HIĐROCACBON THƠM KHÁCC. ỨNG DỤNG CỦA HIĐROCACBON THƠMD. BÀI TẬP BENZEN VÀ HIDROCACBON THƠMVideo liên quan

SureLRN

Hoá 11 bài 35: Tính chất hoá học của Benzen, đồng đẳng Toluen và Hidrocacbon thơm. Về Benzen C6H6 những em đã được ra mắt trong hoá học lớp 9, ở bài này những em sẽ tìm hiểu sâu hơn về tính chất hoá học của benzen, đồng đẳng toluen C7H8 và hidrocacbon thơm như Stiren C8H80, Naphtalen C10H8.
Vậy Benzen C6H6 và đồng đẳng Toluen C7H8 … và một số trong những hidrocacbon thơm như Stiren và Naphtalen có công thức cấu trúc ra làm sao? Tính chất hoá học và tính chất vật lý ra sao tất cả chúng ta sẽ cùng tìm hiểu qua nội dung bài viết rõ ràng này.
A. BENZEN VÀ ĐỒNG ĐẲNG
I. Công thức cấu trúc của benzen, cách gọi tên benzen và đồng đẳng
1. Cấu tạo phân tử Benzen và đồng đẳng
a) Cấu tạo phân tử của benzen
– Sáu nguyên tử C trong phân tử benzen ở trạng thái lai hóa sp2 (lai hóa tam giác).
– Mỗi nguyên tử C sử dụng 3 obitan lai hóa để tạo link σ với 2 nguyên tử C cạnh bên nó và 11 nguyên tử H.
– Sáu obitan p còn sót lại của 6 nguyên tử C xen phủ bên với nhau tạo thành hệ phối hợp π chung cho tất cả vòng benzen. Nhờ vậy mà link π ở benzen tương đối bền vững hơn so với link π ở anken cũng như hiđrocacbon không no khác.
– Mô hình phân tử của benzen dạng đặc và rỗng như sau:
 quy mô cấu trúc phân tử của benzen
quy mô cấu trúc phân tử của benzen
– Biểu diễn công thức cấu trúc dạng rút gọn của Benzen:
 công thức cấu trúc của benzen dạng rút gọn
công thức cấu trúc của benzen dạng rút gọn
b) Benzen và đồng đẳng
– Benzen C6H6 và những hiđrocacbon thơm khác có công thức phân tử là C7H8 (toluen), C8H10 … lập thành dãy đồng đẳng có công thức phân tử chung là CnH2n-6 (n≥6).
2. Cách gọi tên (danh pháp) đồng đẳng, đồng phân của Benzen
– Một số hiđrocacbon thơm đầu dãy đồng đẳng có công thức cấu trúc và tên gọi được trình bày trong bảng sau:
 Cách gọi tên đồng đẳng đồng phân của Benzen
Cách gọi tên đồng đẳng đồng phân của Benzen
Bạn đang xem: Hoá 11 bài 35: Tính chất hoá học của Benzen, đồng đẳng Toluen và Hidrocacbon thơm
– Từ C8H10 trở đi có những đồng phân về vị trí tương đối của những nhóm ankyl xung quanh vòng benzen và về cấu trúc mạch cacbon của mạch nhánh.
– Tên khối mạng lưới hệ thống của những đồng đẳng của benzen được gọi là phương pháp gọi tên những nhóm ankyl + benzen.
II. Tính chất vật lý của Benzen và đồng đẳng
– Các hiđrocacbon thơm đều là chất lỏng hoặc rắn ở điều kiện thường, chúng có nhiệt độ sôi tăng theo chiều tăng của phân tử khối.
– Các hiđrocacbon thơm ở thể lỏng có mùi đặc trưng, không tan trong nước và nhẹ hơn nước, hoàn toàn có thể hoà tan nhiều chất hữu cơ.
III. Tính chất hoá học của Benzen và đồng đẳng
1. Phản ứng thế của Benzen
a) Thế nguyên tử H của vòng benzen
* Benzen phản ứng với halogen: Benzen + Br2
– Cho benzen và brom vào ống nghiệm khô rồi lắc nhẹ hỗn hợp.
– Cho tiếp một ít bột sắt vào ống nghiệm trên, lắc nhẹ. Màu của brom nhạt dần và thấy có khí hiđro bromua thoát ra do đã xảy ra phản ứng thế:

– Nếu cho những ankylbenzen phản ứng với brom trong điều kiện có bột sắt sẽ thu được hỗn hợp sản phẩm thế brom đa phần vào vị trí para và ortho so với nhóm ankyl:

* Benzen phản ứng với axit nitric: Benzen + HNO3
– Cho benzen vào ống nghiệm chứa sẵn hỗn hợp H2SO4 đặc và HNO3 đặc. Khi đó sẽ thấy có lớp chất lỏng nặng màu vàng nhạt lắng xuống. Đó là nitrobenzen được tạo thành theo phản ứng sau:
 * Quy tắc thế: Các ankylbenzen dễ tham gia phản ứng thế nguyên tử H của vòng benzen hơn benzen và sự thế ưu tiên ở vị trí ortho và para so với nhóm ankyl.
* Quy tắc thế: Các ankylbenzen dễ tham gia phản ứng thế nguyên tử H của vòng benzen hơn benzen và sự thế ưu tiên ở vị trí ortho và para so với nhóm ankyl.
b) Thế nguyên tử H của mạch nhánh
– Nếu đun toluen hoặc những ankylbenzen với brom, sẽ xảy ra phản ứng thế nguyên tử H của mạch nhánh tương tự ankan.
– Ví dụ, phản ứng của Toluen với Brom tạo Benzyl bromua:

2. Phản ứn cộng của Benzen
a) Benzen phản ứng cộng hiđro: Benzen + H2
C6H6 + 3H2
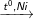 C6H12 (xiclohexan)
C6H12 (xiclohexan)
b) Benzen phản ứng cộng clo: Benzen + Cl2
– Dẫn lượng nhỏ khí clo vào bình chứa một ít benzen, đậy kín lại rồi đưa bình ra ngoài ánh nắng. Trong bình xuất hiện khói trắng và thành bình xuất hiện một lớp bột white color, đó là một trong,2,3,4,5,6-hexa clo xiclohexan (hexacloran).
C6H6 + 3Cl2
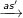 C6H6Cl6 (hexacloran)
C6H6Cl6 (hexacloran)
3. Phản ứng oxi hoá benzen và đồng đẳng
a) Phản ứng oxi hoá không hoàn toàn của benzen và đồng đẳng
– Thí nghiệm:

Benzen và Toluen không làm mất đi màu dung dịch KMnO4 ở điều kiện thường
– Khi đun nóng đồng thời cả hai ống nghiệm trong nồi cách thuỷ:
+ Benzen vẫn không làm mất đi màu dung dịch kali pemanganat KMnO4.
+ Toluen làm mất đi màu dung dịch kali pemanganat, tạo kết tủa mangan đioxit.
C6H5-CH3 (toluen) + KMnO4
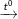 C6H5-COOK (kali benzoat) + 2MnO2↓ + KOH + H2O
C6H5-COOK (kali benzoat) + 2MnO2↓ + KOH + H2O
b) Phản ứng oxi hoá hoàn toàn benzen và đồng đẳng
– Các hiđrocacbon thơm khi cháy toả nhiều nhiệt như PTTQ sau:
CnH2n-6 + [(3n-3)/2]O2
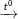 nCO2 + (n-3)H2O
nCO2 + (n-3)H2O
B. MỘT SỐ HIĐROCACBON THƠM KHÁC
I. STIREN (VinylBenzen)
1. Cấu tạo và tính chất vật lí của Stiren
a) Cấu tạo của Stiren
– Công thức phân tử:C8H8
– Công thức cấu trúc của Stiren:

công thức cấu trúc của stiren (vinylbenzen)
b) Tính chất vật lý của Stiren (vinyl benzen)
– Stiren còn gọi là vinylbenzen là chất lỏng không màu, sôi ở 1460C, tan nhiều trong dung môi hữu cơ.
2. Tính chất hoá học của Stiren
a) Stiren phản ứng với dung dịch brom
C6H5-CH=CH2 + Br2 (dd) → C6H5-CHBr-CH2Br
b) Stiren phản ứng với hiđro
– Khi cho stiren tác dụng với hiđro dư có xúc tác ở nhiệt độ và áp suất cao sẽ thu được etylxiclohexan:
 c) Stiren phản ứng trùng hợp
c) Stiren phản ứng trùng hợp
 II. NAPHTALEN
II. NAPHTALEN
1. Cấu tạo và tính chất vật lí Naphtalen
a) Cấu tạo của Naphtalen
– Công thức phân tử: C10H8
– Công thức cấu trúc của naphtalen:

b) Tính chất vật lý của Naphtalen
– Naphtalen (băng phiến) là chất rắn, nóng chảy ở 800C, tan trong benzen, ete,… và có tính thăng hoa.
 2. Tính chất hoá học của Naphtalen
2. Tính chất hoá học của Naphtalen
a) Phản ứng thế của naphtalen
– Naphtalen tham gia phản ứng thế tương tự benzen, nhưng phản ứng xảy ra thuận tiện và đơn giản hơn và thường ưu tiên thế vào vị trí số 1.
• Naphtalen + Br2
 • Naphtalen + HNO3
• Naphtalen + HNO3
 b) Phản ứng cộng hidro của naphtalen
b) Phản ứng cộng hidro của naphtalen
– Khi có chất xúc tác, naphtalen cộng hiđro tạo ra đecalin:
C. ỨNG DỤNG CỦA HIĐROCACBON THƠM
– Benzen là một trong những nguyên vật liệu quan trọng nhất của công nghiệp hóa hữu cơ. Nó được dùng nhiều chất để tổng hợp những monome trong sản xuất polime làm chất dẻo, cao su, tơ sợi (ví dụ điển hình polistiren, cao su buna-stiren, tơ capron).
– Từ benzen người ta điều chế ra nitrobenzen, anilin, phenol dùng để tổng hợp phẩm nhuộm, dược phẩm, thuốc trừ dịch hại,…
– Toluen được dùng để sản xuất thuốc nổ TNT (trinitrotoluen). Ngoài ra, benzen, toluen và những xilen còn được dùng nhiều làm dung môi.
D. BÀI TẬP BENZEN VÀ HIDROCACBON THƠM
Bài 1 trang 159 SGK Hóa 11: Ứng với công thức phân tử C8H10 có bao nhiêu đồng phân hiđrocacbon thơm?
A. 2 ; B. 3 C. 4 ; D. 5
Hãy chọn đáp án đúng
* Lời giải bài 1 trang 159 SGK Hóa 11:
– Đáp án: C.4
– 4 đồng phân hiđrocacbon thơm của C8H10 là:

Bài 2 trang 159 SGK Hóa 11: Toluen và benzen cùng phản ứng được với chất nào sau đây: (1) dung dịch brom trong CCl4; (2) dung dịch kali pemanganat; (3) hiđro có xúc tác Ni, đun nóng; (4) Br2 có bột Fe, đun nóng? Viết phương trình hoá học của những phương trình xảy ra.
* Lời giải bài 2 trang 159 SGK Hóa 11:
– Toluen và benzen cùng phản ứng với hidro có xúc tác Ni khi đung nóng và Br2 có bột Fe đun nóng.
C6H5-CH3 + 3H2
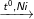 C6H11-CH3
C6H11-CH3
C6H5-CH3 + Br2
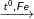 C6H5Br-CH3 + HBr (2 sản phẩm: Brom ở thế ở ví trí o và p)
C6H5Br-CH3 + HBr (2 sản phẩm: Brom ở thế ở ví trí o và p)
C6H6 + 3H2
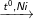 C6H12
C6H12
C6H6 + Br2
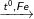 C6H5Br
C6H5Br
Bài 4 trang 160 SGK Hóa 11: Trình bày phương pháp hoá học phân biệt những chất: benzen, hex-1-en và toluen. Viết phương trình hoá học của những phản ứng đã dùng
* Lời giải bài 4 trang 160 SGK Hóa 11:
– Cho những chất lần lượt tác dụng với dung dịch Br2, chất nào làm nhạt màu dung dịch Br2 thì đó là hex-1-en.
– Cho 2 chất còn sót lại qua dung dịch KMnO4, chất nào làm mất đi màu dung dịch KMnO4 thì đó là toluen.
– Các phương trình phản ứng:
CH2=CH-[CH2]3-CH3 + Br2 (dd nâu đỏ) → CH2Br-CHBr-[CH2]3-CH3 (không màu)
C6H5-CH3 + 2KMnO4
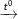 C6H5-COOK + 2MnO2 + KOH + H2O
C6H5-COOK + 2MnO2 + KOH + H2O
Bài 5 trang 160 SGK Hóa 11: Hiđrocacbon X là chất lỏng có tỉ khối hơi so với không khí bằng 3,17. Đốt cháy hoàn toàn thu được CO2 có khối lượng bằng 4,28 lần khối lượng của nước. Ở nhiệt độ thường, X không làm mất đi màu dung dịch brom; khi đun nóng, X làm mất đi màu KMnO4.
a) Tìm công thức phân tử và viết công thức cấu trúc của X?
b) Viết phương trình hoá học của phản ứng giữa X với H2 (xúc tác Ni, đun nóng), với brom (xuất hiện bột Fe), với hỗn hợp dư của axit HNO3 và axit H2SO4 đậm đặc.
* Lời giải bài 5 trang 160 SGK Hóa 11:
– Ta có: MX = 3,17. 29 = 92 ⇒ 12x + y = 92 (*)
– Gọi CTPT của X là CxHy:
CxHy + [(x+y)/4]O2 → xCO2 + (y/2)H2O
– Theo bài ra, ta có: mCO2 = 4,28mH2O ⇒ 44x = 4,28.18.(y/2)⇒ y = 1,14x (**)
– Từ (*) và (**) ⇒ x = 7, y = 8. CTPT của X là C7H8
– Từ đề bài ⇒ CTCT của X là Toluen: C6H5-CH3
– Các phương trình phản ứng hoá học:
C6H5-CH3 + 3H2
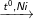 C6H11-CH3
C6H11-CH3
C6H5-CH3 + Br2
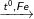 C6H5Br-CH3 + HBr (2 sản phẩm: Brom ở thế ở ví trí o và p)
C6H5Br-CH3 + HBr (2 sản phẩm: Brom ở thế ở ví trí o và p)
C6H5-CH3 + HNO3
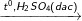 C6H5NO2-CH3 + HBr (2 sản phẩm: NO2 ở thế ở ví trí o và p)
C6H5NO2-CH3 + HBr (2 sản phẩm: NO2 ở thế ở ví trí o và p)
Bài 6 trang 160 SGK Hóa 11: Đánh dấu (+) vào ô cặp chất phản ứng với nhau theo mẫu sau:
Benzen Hexen Toluen Eilen H2, xúc tác Ni + + Br2 (dd) Br2 có Fe, đun nóng dd KMnO4, nóng HBr H2O (xt H+)* Lời giải bài 6 trang 160 SGK Hóa 11:
Benzen Hexen Toluen Eilen H2, xúc tác Ni + + + + Br2 (dd) + + Br2 có Fe, đun nóng + + dd KMnO4, nóng + + + HBr + + H2O (xt H+) + +Bài 7 trang 160 SGK Hóa 11: Cho benzen tác dụng với lượng dư HNO3 đặc có xúc tác H2SO4đặc để điều chế nitrobenzen. Tính khối lượng nitrobenzen thu được khi sử dụng 1,00 tấn benzen với hiệu suất 78,0%.
* Lời giải bài 7 trang 160 SGK Hóa 11:
– Phương trình phản ứng:
C6H6 + HNO3
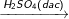 C6H5NO2 + H2O
C6H5NO2 + H2O
78 (g) 123(g)
106.78% (g) x (g)?
– Do H = 78% nên lượng nitro benzen thu được là:
 % = 1,23.106(g) = 1,23 (tấn)
% = 1,23.106(g) = 1,23 (tấn)
Bài 8 trang 160 SGK Hóa 11: So sánh tính chất hoá học của etylbenzen với stiren, viết phương trình hoá học của phản ứng để minh hoạ.
* Lời giải bài 8 trang 160 SGK Hóa 11:
a) Sự giống nhau giữa benzen và stiren là đều phản ứng thế
b) Sự rất khác nhau giữa benzen và stiren
– Etylbenzen có tính chất giống ankan (thể hiện phản ứng cộng Cl2 với ánh sáng khuếch tán)
– Stiren có tính chất giống anken (thể hiện phản ứng làm mất đi màu dung dịch brom và trùng hợp tạo polime)
– PTPƯ những bạn xem lại bài giảng ở trên và tự viết.
Bài 10 trang 160 SGK Hóa 11: Trình bày phương pháp hoá học phân biệt 3 chất lỏng sau: toluen, benzen, stiren. Viết phương trình hoá học của những phản ứng hoá học đã dùng.
* Lời giải bài 10 trang 160 SGK Hóa 11:
– Cho 3 chất lỏng tác dụng với dung dịch KMnO4 ở nhiệt độ thường, chất nào làm mất đi màu dung dịch KMnO4 ở nhiệt độ thường là stiren.
– Với 2 hỗn hợp phản ứng còn sót lại ta đem đun nóng, chất nào làm mất đi màu dung dịch KMnO4(nóng) thì là toluen, còn sót lại là benzen.
– PTPƯ (tự viết theo bài giảng ở trên).
Bài 11 trang 160 SGK Hóa 11: Khi tách hiđro của 66,25 kg etylbenzen thu được 52,00 kg stiren. Tiến hành phản ứng trùng hợp toàn bộ lượng stiren này thu được hỗn hợp A gồm polistiren và phần stiren chưa tham gia phản ứng. Biết 5,20 gam A vừa đủ làm mất đi màu của 60,00 ml dung dịch brom 0,15M.
a) Tính hiệu suất của phản ứng tách hiđro của etylbenzen.
b) Tính khối lượng stiren đã trùng hợp.
c) Polistren có phân tử khối trung bình bằng 3,12.105. Tính thông số trùng hợp trung bình của polime.
* Lời giải bài 11 trang 160 SGK Hóa 11:
a) PTPƯ tách Hidro
C6H5-CH2-CH3
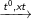 C6H5-CH=CH2 + H2 (1)
C6H5-CH=CH2 + H2 (1)
106 kg 104 kg
66,25 kg x kg
– Theo PTPƯ ở trên ⇒
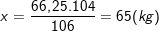
– Mà theo bài ra ta thu được 52kg stiren nên:
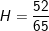 .100% = 80%
.100% = 80%
b) Các phương trình phản ứng
– Phản ứng trùng hợp stiren:

– Phản ứng cộng Brom
C6H5-CH=CH2 + Br2
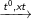 C6H5-CHBr-CH2Br
C6H5-CHBr-CH2Br
– Theo bài ra, ta có: nBr2 = 0,06.0,15 = 0,009(mol)
– Theo định luật bảo toàn khố lượng: mA = mstiren = 52,00 (kg) = 52.000(g)
– Theo đề bài: 5,2 g A tác dụng vừa đủ với 0,009 mol Br2
52.000 g A tác dụng vừa đủ với 90 mol Br2
– Theo PTPƯ cộng brom thì: nstiren = nBr2 = 90(mol)
⇒ mstiren = 90.104 = 9360(g) = 9,36(kg)
⇒ Khối lượng stiren đã tham gia trùng hợp là: mA – mstiren = 52 – 9,36 = 42,64 (kg)
c) Hệ số trùng hợp là:

Hy vọng với nội dung bài viết về tính chất hoá học, công thức cấu trúc của Benzen, Toluen và đồng đẳng hidrocacbon thơm ở trên giúp ích cho những em. Mọi góp ý và thắc mắc những em hãy để lại dưới phần phản hồi để thầy cô ghi nhận và tương hỗ, chúc những em học tập tốt.
Đăng bởi: THPT Sóc Trăng
Chuyên mục: Giáo Dục
Hoá 11 bài 35: Tính chất hoá học của Benzen, đồng đẳng Toluen và Hidrocacbon thơm. Về Benzen C6H6 những em đã được ra mắt trong hoá học lớp 9, ở bài này những em sẽ tìm hiểu sâu hơn về tính chất hoá học của benzen, đồng đẳng toluen C7H8 và hidrocacbon thơm như Stiren C8H80, Naphtalen C10H8. Vậy Benzen C6H6 và đồng đẳng Toluen C7H8 … và một số trong những hidrocacbon thơm như Stiren và Naphtalen có công thức cấu trúc ra làm sao? Tính chất hoá học và tính chất vật lý ra sao tất cả chúng ta sẽ cùng tìm hiểu qua nội dung bài viết rõ ràng này. A. BENZEN VÀ ĐỒNG ĐẲNG I. Công thức cấu trúc của benzen, cách gọi tên benzen và đồng đẳng 1. Cấu tạo phân tử Benzen và đồng đẳng a) Cấu tạo phân tử của benzen – Sáu nguyên tử C trong phân tử benzen ở trạng thái lai hóa sp2 (lai hóa tam giác). – Mỗi nguyên tử C sử dụng 3 obitan lai hóa để tạo link σ với 2 nguyên tử C cạnh bên nó và 11 nguyên tử H. – Sáu obitan p còn sót lại của 6 nguyên tử C xen phủ bên với nhau tạo thành hệ phối hợp π chung cho tất cả vòng benzen. Nhờ vậy mà link π ở benzen tương đối bền vững hơn so với link π ở anken cũng như hiđrocacbon không no khác. – Mô hình phân tử của benzen dạng đặc và rỗng như sau: quy mô cấu trúc phân tử của benzen – Biểu diễn công thức cấu trúc dạng rút gọn của Benzen: công thức cấu trúc của benzen dạng rút gọn b) Benzen và đồng đẳng – Benzen C6H6 và những hiđrocacbon thơm khác có công thức phân tử là C7H8 (toluen), C8H10 … lập thành dãy đồng đẳng có công thức phân tử chung là CnH2n-6 (n≥6). 2. Cách gọi tên (danh pháp) đồng đẳng, đồng phân của Benzen – Một số hiđrocacbon thơm đầu dãy đồng đẳng có công thức cấu trúc và tên gọi được trình bày trong bảng sau: Cách gọi tên đồng đẳng đồng phân của Benzen – Từ C8H10 trở đi có những đồng phân về vị trí tương đối của những nhóm ankyl xung quanh vòng benzen và về cấu trúc mạch cacbon của mạch nhánh. – Tên khối mạng lưới hệ thống của những đồng đẳng của benzen được gọi là phương pháp gọi tên những nhóm ankyl + benzen. II. Tính chất vật lý của Benzen và đồng đẳng – Các hiđrocacbon thơm đều là chất lỏng hoặc rắn ở điều kiện thường, chúng có nhiệt độ sôi tăng theo chiều tăng của phân tử khối. – Các hiđrocacbon thơm ở thể lỏng có mùi đặc trưng, không tan trong nước và nhẹ hơn nước, hoàn toàn có thể hoà tan nhiều chất hữu cơ. III. Tính chất hoá học của Benzen và đồng đẳng 1. Phản ứng thế của Benzen a) Thế nguyên tử H của vòng benzen * Benzen phản ứng với halogen: Benzen + Br2 – Cho benzen và brom vào ống nghiệm khô rồi lắc nhẹ hỗn hợp. – Cho tiếp một ít bột sắt vào ống nghiệm trên, lắc nhẹ. Màu của brom nhạt dần và thấy có khí hiđro bromua thoát ra do đã xảy ra phản ứng thế: – Nếu cho những ankylbenzen phản ứng với brom trong điều kiện có bột sắt sẽ thu được hỗn hợp sản phẩm thế brom đa phần vào vị trí para và ortho so với nhóm ankyl: * Benzen phản ứng với axit nitric: Benzen + HNO3 – Cho benzen vào ống nghiệm chứa sẵn hỗn hợp H2SO4 đặc và HNO3 đặc. Khi đó sẽ thấy có lớp chất lỏng nặng màu vàng nhạt lắng xuống. Đó là nitrobenzen được tạo thành theo phản ứng sau: * Quy tắc thế: Các ankylbenzen dễ tham gia phản ứng thế nguyên tử H của vòng benzen hơn benzen và sự thế ưu tiên ở vị trí ortho và para so với nhóm ankyl. b) Thế nguyên tử H của mạch nhánh – Nếu đun toluen hoặc những ankylbenzen với brom, sẽ xảy ra phản ứng thế nguyên tử H của mạch nhánh tương tự ankan. – Ví dụ, phản ứng của Toluen với Brom tạo Benzyl bromua: 2. Phản ứn cộng của Benzen a) Benzen phản ứng cộng hiđro: Benzen + H2 C6H6 + 3H2 C6H12 (xiclohexan) b) Benzen phản ứng cộng clo: Benzen + Cl2 – Dẫn lượng nhỏ khí clo vào bình chứa một ít benzen, đậy kín lại rồi đưa bình ra ngoài ánh nắng. Trong bình xuất hiện khói trắng và thành bình xuất hiện một lớp bột white color, đó là một trong,2,3,4,5,6-hexa clo xiclohexan (hexacloran). C6H6 + 3Cl2 C6H6Cl6 (hexacloran) 3. Phản ứng oxi hoá benzen và đồng đẳng a) Phản ứng oxi hoá không hoàn toàn của benzen và đồng đẳng – Thí nghiệm: Benzen và Toluen không làm mất đi màu dung dịch KMnO4 ở điều kiện thường – Khi đun nóng đồng thời cả hai ống nghiệm trong nồi cách thuỷ: + Benzen vẫn không làm mất đi màu dung dịch kali pemanganat KMnO4. + Toluen làm mất đi màu dung dịch kali pemanganat, tạo kết tủa mangan đioxit. C6H5-CH3 (toluen) + KMnO4 C6H5-COOK (kali benzoat) + 2MnO2↓ + KOH + H2O b) Phản ứng oxi hoá hoàn toàn benzen và đồng đẳng – Các hiđrocacbon thơm khi cháy toả nhiều nhiệt như PTTQ sau: CnH2n-6 + [(3n-3)/2]O2 nCO2 + (n-3)H2O B. MỘT SỐ HIĐROCACBON THƠM KHÁC I. STIREN (VinylBenzen) 1. Cấu tạo và tính chất vật lí của Stiren a) Cấu tạo của Stiren – Công thức phân tử:C8H8 – Công thức cấu trúc của Stiren: công thức cấu trúc của stiren (vinylbenzen) b) Tính chất vật lý của Stiren (vinyl benzen) – Stiren còn gọi là vinylbenzen là chất lỏng không màu, sôi ở 1460C, tan nhiều trong dung môi hữu cơ. 2. Tính chất hoá học của Stiren a) Stiren phản ứng với dung dịch brom C6H5-CH=CH2 + Br2 (dd) → C6H5-CHBr-CH2Br b) Stiren phản ứng với hiđro – Khi cho stiren tác dụng với hiđro dư có xúc tác ở nhiệt độ và áp suất cao sẽ thu được etylxiclohexan: c) Stiren phản ứng trùng hợp II. NAPHTALEN 1. Cấu tạo và tính chất vật lí Naphtalen a) Cấu tạo của Naphtalen – Công thức phân tử: C10H8 – Công thức cấu trúc của naphtalen: b) Tính chất vật lý của Naphtalen – Naphtalen (băng phiến) là chất rắn, nóng chảy ở 800C, tan trong benzen, ete,… và có tính thăng hoa. 2. Tính chất hoá học của Naphtalen a) Phản ứng thế của naphtalen – Naphtalen tham gia phản ứng thế tương tự benzen, nhưng phản ứng xảy ra thuận tiện và đơn giản hơn và thường ưu tiên thế vào vị trí số 1. • Naphtalen + Br2 • Naphtalen + HNO3 b) Phản ứng cộng hidro của naphtalen – Khi có chất xúc tác, naphtalen cộng hiđro tạo ra đecalin: C. ỨNG DỤNG CỦA HIĐROCACBON THƠM – Benzen là một trong những nguyên vật liệu quan trọng nhất của công nghiệp hóa hữu cơ. Nó được dùng nhiều chất để tổng hợp những monome trong sản xuất polime làm chất dẻo, cao su, tơ sợi (ví dụ điển hình polistiren, cao su buna-stiren, tơ capron). – Từ benzen người ta điều chế ra nitrobenzen, anilin, phenol dùng để tổng hợp phẩm nhuộm, dược phẩm, thuốc trừ dịch hại,… – Toluen được dùng để sản xuất thuốc nổ TNT (trinitrotoluen). Ngoài ra, benzen, toluen và những xilen còn được dùng nhiều làm dung môi. D. BÀI TẬP BENZEN VÀ HIDROCACBON THƠM Bài 1 trang 159 SGK Hóa 11: Ứng với công thức phân tử C8H10 có bao nhiêu đồng phân hiđrocacbon thơm? A. 2 ; B. 3 C. 4 ; D. 5 Hãy chọn đáp án đúng * Lời giải bài 1 trang 159 SGK Hóa 11: – Đáp án: C.4 – 4 đồng phân hiđrocacbon thơm của C8H10 là: Bài 2 trang 159 SGK Hóa 11: Toluen và benzen cùng phản ứng được với chất nào sau đây: (1) dung dịch brom trong CCl4; (2) dung dịch kali pemanganat; (3) hiđro có xúc tác Ni, đun nóng; (4) Br2 có bột Fe, đun nóng? Viết phương trình hoá học của những phương trình xảy ra. * Lời giải bài 2 trang 159 SGK Hóa 11: – Toluen và benzen cùng phản ứng với hidro có xúc tác Ni khi đung nóng và Br2 có bột Fe đun nóng. C6H5-CH3 + 3H2 C6H11-CH3 C6H5-CH3 + Br2 C6H5Br-CH3 + HBr (2 sản phẩm: Brom ở thế ở ví trí o và p) C6H6 + 3H2 C6H12 C6H6 + Br2 C6H5Br Bài 4 trang 160 SGK Hóa 11: Trình bày phương pháp hoá học phân biệt những chất: benzen, hex-1-en và toluen. Viết phương trình hoá học của những phản ứng đã dùng * Lời giải bài 4 trang 160 SGK Hóa 11: – Cho những chất lần lượt tác dụng với dung dịch Br2, chất nào làm nhạt màu dung dịch Br2 thì đó là hex-1-en. – Cho 2 chất còn sót lại qua dung dịch KMnO4, chất nào làm mất đi màu dung dịch KMnO4 thì đó là toluen. – Các phương trình phản ứng: CH2=CH-[CH2]3-CH3 + Br2 (dd nâu đỏ) → CH2Br-CHBr-[CH2]3-CH3 (không màu) C6H5-CH3 + 2KMnO4 C6H5-COOK + 2MnO2 + KOH + H2O Bài 5 trang 160 SGK Hóa 11: Hiđrocacbon X là chất lỏng có tỉ khối hơi so với không khí bằng 3,17. Đốt cháy hoàn toàn thu được CO2 có khối lượng bằng 4,28 lần khối lượng của nước. Ở nhiệt độ thường, X không làm mất đi màu dung dịch brom; khi đun nóng, X làm mất đi màu KMnO4. a) Tìm công thức phân tử và viết công thức cấu trúc của X? b) Viết phương trình hoá học của phản ứng giữa X với H2 (xúc tác Ni, đun nóng), với brom (xuất hiện bột Fe), với hỗn hợp dư của axit HNO3 và axit H2SO4 đậm đặc. * Lời giải bài 5 trang 160 SGK Hóa 11: – Ta có: MX = 3,17. 29 = 92 ⇒ 12x + y = 92 (*) – Gọi CTPT của X là CxHy: CxHy + [(x+y)/4]O2 → xCO2 + (y/2)H2O – Theo bài ra, ta có: mCO2 = 4,28mH2O ⇒ 44x = 4,28.18.(y/2)⇒ y = 1,14x (**) – Từ (*) và (**) ⇒ x = 7, y = 8. CTPT của X là C7H8 – Từ đề bài ⇒ CTCT của X là Toluen: C6H5-CH3 – Các phương trình phản ứng hoá học: C6H5-CH3 + 3H2 C6H11-CH3 C6H5-CH3 + Br2 C6H5Br-CH3 + HBr (2 sản phẩm: Brom ở thế ở ví trí o và p) C6H5-CH3 + HNO3 C6H5NO2-CH3 + HBr (2 sản phẩm: NO2 ở thế ở ví trí o và p) Bài 6 trang 160 SGK Hóa 11: Đánh dấu (+) vào ô cặp chất phản ứng với nhau theo mẫu sau: Benzen Hexen Toluen Eilen H2, xúc tác Ni + + Br2 (dd) Br2 có Fe, đun nóng dd KMnO4, nóng HBr H2O (xt H+) * Lời giải bài 6 trang 160 SGK Hóa 11: Benzen Hexen Toluen Eilen H2, xúc tác Ni + + + + Br2 (dd) + + Br2 có Fe, đun nóng + + dd KMnO4, nóng + + + HBr + + H2O (xt H+) + + Bài 7 trang 160 SGK Hóa 11: Cho benzen tác dụng với lượng dư HNO3 đặc có xúc tác H2SO4đặc để điều chế nitrobenzen. Tính khối lượng nitrobenzen thu được khi sử dụng 1,00 tấn benzen với hiệu suất 78,0%. * Lời giải bài 7 trang 160 SGK Hóa 11: – Phương trình phản ứng: C6H6 + HNO3 C6H5NO2 + H2O 78 (g) 123(g) 106.78% (g) x (g)? – Do H = 78% nên lượng nitro benzen thu được là: % = 1,23.106(g) = 1,23 (tấn) Bài 8 trang 160 SGK Hóa 11: So sánh tính chất hoá học của etylbenzen với stiren, viết phương trình hoá học của phản ứng để minh hoạ. * Lời giải bài 8 trang 160 SGK Hóa 11: a) Sự giống nhau giữa benzen và stiren là đều phản ứng thế b) Sự rất khác nhau giữa benzen và stiren – Etylbenzen có tính chất giống ankan (thể hiện phản ứng cộng Cl2 với ánh sáng khuếch tán) – Stiren có tính chất giống anken (thể hiện phản ứng làm mất đi màu dung dịch brom và trùng hợp tạo polime) – PTPƯ những bạn xem lại bài giảng ở trên và tự viết. Bài 10 trang 160 SGK Hóa 11: Trình bày phương pháp hoá học phân biệt 3 chất lỏng sau: toluen, benzen, stiren. Viết phương trình hoá học của những phản ứng hoá học đã dùng. * Lời giải bài 10 trang 160 SGK Hóa 11: – Cho 3 chất lỏng tác dụng với dung dịch KMnO4 ở nhiệt độ thường, chất nào làm mất đi màu dung dịch KMnO4 ở nhiệt độ thường là stiren. – Với 2 hỗn hợp phản ứng còn sót lại ta đem đun nóng, chất nào làm mất đi màu dung dịch KMnO4(nóng) thì là toluen, còn sót lại là benzen. – PTPƯ (tự viết theo bài giảng ở trên). Bài 11 trang 160 SGK Hóa 11: Khi tách hiđro của 66,25 kg etylbenzen thu được 52,00 kg stiren. Tiến hành phản ứng trùng hợp toàn bộ lượng stiren này thu được hỗn hợp A gồm polistiren và phần stiren chưa tham gia phản ứng. Biết 5,20 gam A vừa đủ làm mất đi màu của 60,00 ml dung dịch brom 0,15M. a) Tính hiệu suất của phản ứng tách hiđro của etylbenzen. b) Tính khối lượng stiren đã trùng hợp. c) Polistren có phân tử khối trung bình bằng 3,12.105. Tính thông số trùng hợp trung bình của polime. * Lời giải bài 11 trang 160 SGK Hóa 11: a) PTPƯ tách Hidro C6H5-CH2-CH3 C6H5-CH=CH2 + H2 (1) 106 kg 104 kg 66,25 kg x kg – Theo PTPƯ ở trên ⇒ – Mà theo bài ra ta thu được 52kg stiren nên: .100% = 80% b) Các phương trình phản ứng – Phản ứng trùng hợp stiren: – Phản ứng cộng Brom C6H5-CH=CH2 + Br2 C6H5-CHBr-CH2Br – Theo bài ra, ta có: nBr2 = 0,06.0,15 = 0,009(mol) – Theo định luật bảo toàn khố lượng: mA = mstiren = 52,00 (kg) = 52.000(g) – Theo đề bài: 5,2 g A tác dụng vừa đủ với 0,009 mol Br2 52.000 g A tác dụng vừa đủ với 90 mol Br2 – Theo PTPƯ cộng brom thì: nstiren = nBr2 = 90(mol) ⇒ mstiren = 90.104 = 9360(g) = 9,36(kg) ⇒ Khối lượng stiren đã tham gia trùng hợp là: mA – mstiren = 52 – 9,36 = 42,64 (kg) c) Hệ số trùng hợp là: Hy vọng với nội dung bài viết về tính chất hoá học, công thức cấu trúc của Benzen, Toluen và đồng đẳng hidrocacbon thơm ở trên giúp ích cho những em. Mọi góp ý và thắc mắc những em hãy để lại dưới phần phản hồi để thầy cô ghi nhận và tương hỗ, chúc những em học tập tốt. Đăng bởi: THPT Sóc Trăng Chuyên mục: Giáo Dục
Bản quyền nội dung bài viết thuộc trường THPT thành Phố Sóc Trăng. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường THPT Sóc Trăng (thptsoctrang.edu)
Tải thêm tài liệu liên quan đến nội dung bài viết Sản phẩm tạo thành tử phản ứng cộng H2 của Toluen khí có xúc tác Ni là
Post a Comment